二组织展分布成长调的组控研肌内结缔及生究进
1.1胶原蛋白
1.1.1胶原蛋白的肌内结缔进展分子组装与种类分布
IMCT中最丰富的蛋白质是胶原蛋白,它是组织细胞外基质的主要成分,是组调控一种富含羟脯氨酸的蛋白质,哺乳动物肌肉中胶原蛋白含量达12.8%。成分胶原蛋白包含20种氨基酸中的布及18种,每个胶原蛋白分子中含有约33%的生长甘氨酸、12%的研究脯氨酸和11%的羟脯氨酸,蛋氨酸、肌内结缔进展半胱氨酸和酪氨酸含量低,组织色氨酸缺乏。组调控胶原蛋白的成分一级结构中富含Gly-X-Y重复序列,其中X和Y位置通常被脯氨酸(Pro)和羟脯氨酸(Hyp)占据。布及每个胶原蛋白分子的生长中心区域由3条α-链各自盘绕成左旋螺旋,再相互缠绕形成右手超螺旋,研究其与螺旋末端的肌内结缔进展无规卷曲部分共同构成原胶原蛋白。原胶原蛋白分子再自我组装形成胶原原纤维,胶原原纤维进一步聚集形成胶原纤维,以及各种不同结缔组织。
目前已发现编码29种类型胶原蛋白的基因,在骨骼肌中至少存在7种胶原蛋白类型——I,III,IV,V,VI,XII和XIV。骨骼肌中胶原蛋白的主要类型是I型和III型,它们成四分之一交错排列在组织中形成原纤维。I型胶原蛋白是肌外膜的主要成分,I型和III型在肌束膜中含量多,而在肌内膜中主要是III型、IV型和V型,如图3所示,这些结缔组织共同赐予肌肉一定的韧度。因为肌肉间的肌外膜在加热煮制加工过程中通常被修整掉,所以III、IV和V型胶原蛋白对肉韧度的贡献要比I型大一些。
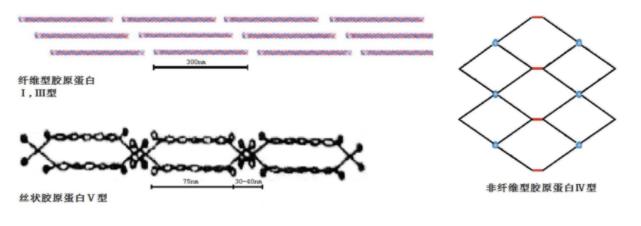

1.1.2胶原蛋白的交联
胶原蛋白分子的分层组装和堆积可为不同的组织提供结构稳定性、机械完整性和弹性,其作用随着分子间的共价交联而增强。除了单个胶原蛋白分子的三螺旋结构之外,胶原蛋白还通过翻译后修饰形成的分子间和分子内的交联获得了额外的机械性能和化学稳定性。该过程是通过赖氨酸氧化酶的作用将特定的赖氨酸和羟赖氨酸残基转化为相应的醛而引发的,使在同一分子和相邻分子中与并列的赖氨酸醛、赖氨酸、羟基赖氨酸和组氨酸残基发生一系列缩合反应,从而导致二价、三价和四价交联。交联以3种共价键形式存在:(1)二硫键,由于仅含有半胱氨酸而被限制在III型和IV型中;(2)2条α链中赖氨酸和羟赖氨酸的醛基氧化形成的,在体外可还原;(3)更复杂的键,连接2个以上的α链,主要是胶原蛋白的老化过程中产生的(成熟交联)。
分子内交联是通过赖氨酰氧化酶作用于胶原蛋白的氨基和羧基端肽,将选定的赖氨酸和羟赖氨酸残基转化为醛基赖氨酸和羟基赖氨酸,可在纤维形成过程中通过醇醛缩合自发反应,如图4所示,当胶原蛋白分子内的2个α链精确并联排列时才能形成。因此,α链二聚体是由两条α链的端肽段之间的分子内交联产生的。分子内交联不影响胶原纤维的稳定性,而分子间的交联影响胶原纤维的稳定性。
分子间交联发生在胶原蛋白三聚体的端肽与四分之一交错的相邻三聚体的螺旋区域之间。胶原原纤维中1条α链上的赖氨酸醛基与其邻近的赖氨酸或羟赖氨酸ε-氨基反应生成稳定的醛胺类物质(脱氢羟赖氨酰异亮氨酸,Dehydro-hydroxylysinonorleucine),该物质具有还原性和热不稳定性,可被还原成羟赖氨酰异亮氨酸(Hydro-xylysinonorleucine),这些交联的化学性质取决于胶原组织的性质和年龄。交联的差异是由于三螺旋中端肽和特定赖氨酸的羟基化程度所致。这些二价交联仅是中间体,随后与组氨酸、赖氨酸或羟赖氨酸残基多次缩合转化为稳定的三价交联——组氨酸-羟基-赖氨酸正亮氨酸、羟赖氨酸吡啶啉和赖氨酸吡啶啉,并且随着成熟过程中胶原蛋白合成代谢的减少,三价交联在组织中不断累积。大部分成熟的交联在动物生命后期形成,其局部浓度取决于形成它们的组织、年龄、性别、活动和身体状态。
在动物生长发育过程中,随着非还原性交联的增加,使肌肉中的胶原蛋白不断地互相形成三维网状结构,增加了肌肉的韧性,同时胶原蛋白的可溶解性越来越低。此外,胶原纤维变粗可能也会导致韧性增加。
降解现有的IMCT结构和成分并合成新的替代成分的过程称为胶原蛋白的合成代谢。未成熟交联占比高表明主要是新的胶原蛋白合成,例如:在组织生长、纤维化、伤口愈合和骨折修复中。相反,成熟的交联占优势则表明胶原合成代谢程度低。因此,未成熟与成熟交联的比例可作为胶原组织代谢率的指标。动物成熟后胶原组织的合成代谢减少,胶原蛋白中葡萄糖和赖氨酸的ε-氨基反应,形成第二种交联机制,通常称为非酶糖基化,与精氨酸形成环状结构,生成葡萄糖苷,与之类似的结构如戊糖苷,在分子间交联的形成中发挥作用,如图4中④所示。
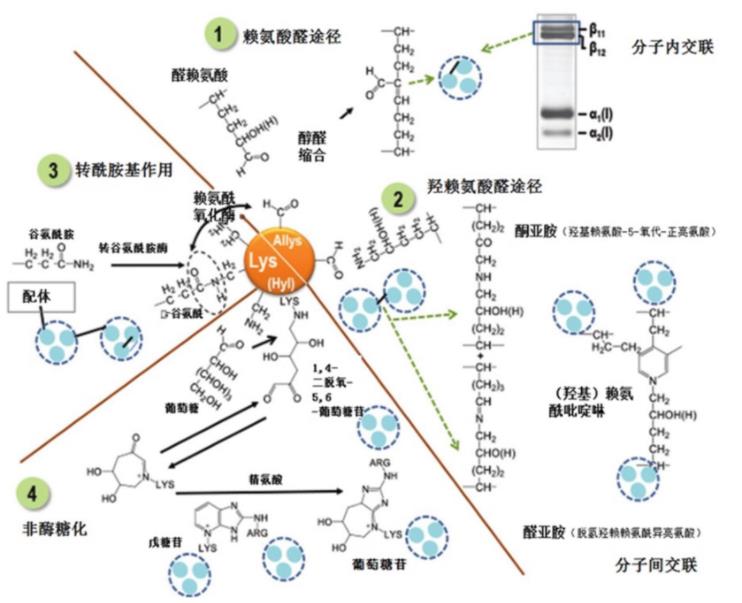

此外,转谷氨酰胺酶可介导胶原蛋白的交联,可将非胶原配体固定在胶原上,从而形成分子内、分子间交联,如图4中③所示。
声明:本文所用图片、文字来源《中国食品学报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系删除。
相关链接:结缔组织,胶原蛋白,胶原纤维
本文地址:http://ie2r8.impactiveimprints.com/news/35b56399401.html
版权声明
本文仅代表作者观点,不代表本站立场。
本文系作者授权发表,未经许可,不得转载。